食品メーカー対象 水分活性の完全ガイド

水は安価な原料ではありますが、微生物の生育、カビの発生、食感の低下、固結、腐敗、ビタミンの損失など、多大な金銭的損失を伴うたくさんの問題を引き起こす可能性があります。製品に含まれる水分を理解する最良の方法は、水分活性の測定方法を学ぶことです。
なぜ水分活性?
水分活性が品質や安全性の測定に有用であることが示唆されたのは、水分含量だけでは微生物の生育の変動を適切に説明できないことが明らかになったためです。水分活性(aw)の概念は何十年もの間、微生物学者や食品技術者の間で用いられてきました。水分活性は、安全性と品質の基準として最も一般的に使用されています。
水分活性:要するに水のエネルギー
水分活性とは?
コップ一杯の水と乾いたスポンジを用意します。スポンジの角をコップの水につけます。水はコップからスポンジに移動します。
水分活性とは、水をスポンジの中に移動させる力です。では、スポンジの中の水とコップの中の水がどう違うかを考えてみましょう。
まず気づくのは、コップの中の水は自由に動き回れますが、スポンジの中の水は自由ではないということです。水素結合、毛細管力、ファンデルワールス-ロンドン力によって結合しているからです。これをマトリックス効果と呼びます。つまり、スポンジの水はコップの中の水よりもエネルギーが低い状態にあると言えます。したがって、より高いエネルギー状態にあるコップの中の水はスポンジの中に流れ込みます。それを戻すには、スポンジを絞るという作業が必要となります。
また、スポンジの中の水はコップの中の水よりも蒸気圧と凝固点が低く、逆に沸点は高いです。測定や定量化という点からも、スポンジの中の水とコップの中の水は違います。
水のエネルギーは、溶質で希釈することによっても減少させることができます。これは浸透圧効果と呼ばれるものです。水を純粋で自由な状態に戻すためにはエネルギーが必要なので、これも水分活性を低下させます。この浸透圧効果と前に述べたマトリックス効果の和が、エネルギー変化の総和となります。
水分活性は食品の品質と安全性を左右する
水分含量20%のクラッカーと30%のチーズフィリングを組み合わせます。クラッカーは湿気てしまうでしょうか。2つの材料の水分活性が同じであれば、そうはなりません。また、スパイスを製造するときにダマになったり固まったりしないようにするにはどうすればいいでしょうか。組み合わせる原材料の水分活性を同じにすれば、問題は解決します。
水分活性はビタミンの劣化にも影響を与えます。脂質の酸化、歯ごたえ、噛みごたえ、柔らかさ、その他多くの品質要素も同様です。水分含量は、製品に含まれる水分の量は教えてくれますが、それだけです。その他の品質や安全性の問題を予測することはできません。
安全性と安定性の予測
水分活性は、微生物の生育、化学・生化学的反応速度、物理的特性に関して、安全性と安定性を予測します。図1は、水分活性に応じた微生物の生育限界と分解反応の速度から見た安定性を示したものです。
水分活性を測定し、管理することで可能になること
- 腐敗や感染の原因となる微生物を予測する
- 製品の化学的安定性を維持する
- 非酵素的な褐変反応や自発的な自己触媒的脂質酸化反応を最小化する
- 酵素とビタミンの活性を長持ちさせる
- 水分移動、食感、保存性など製品の物理的特性を最適化する
水分活性の測定方法
試料を密閉容器に入れると、やがて、ヘッドスペース(試料上部の空気層)の空気の相対湿度が試料の水分活性と平衡になります。平衡状態では試料とヘッドスペースは同等の状態となりますから、ヘッドスペースの相対湿度を測定することで試料の水分活性を知ることができます。これが、水分活性はどのように測定するのかという問いへの最も信頼できる答えと言えましょう。
二次的方法:湿度計、静電容量センサー
最近の測定装置の多くは電気容量式または抵抗式の湿度計センサーを使用して試料上部のヘッドスペースの湿度を測定しています。これは初期の水分活性計に倣ったものです。
これらの測定装置は、電気信号と相対湿度を関連付けるという二次的な方法を採用しており、既知の標準塩を使用して校正する必要があります。
これらのセンサーでは、試料とセンサーの温度が同じである限り、平衡相対湿度は試料の水分活性と等しくなります。正確な測定には厳密な温度制御と温度測定が必要です。静電容量センサーはシンプルな設計で、比較的安価な水分活性計によく使用されています。
チルドミラー露点式は一次的測定方法
P0(飽和蒸気圧)は試料の温度のみに依存するため(添付のグラフの通り)、試料の温度を測定することでp0を測定することが可能です。P(試料中の水の蒸気圧)は、試料の上の密閉されたヘッドスペースの水の蒸気圧を測定することで測定できます。その蒸気圧を最も正確に測定する方法は、第一原理に立ち返って、空気の露点を測定することです。
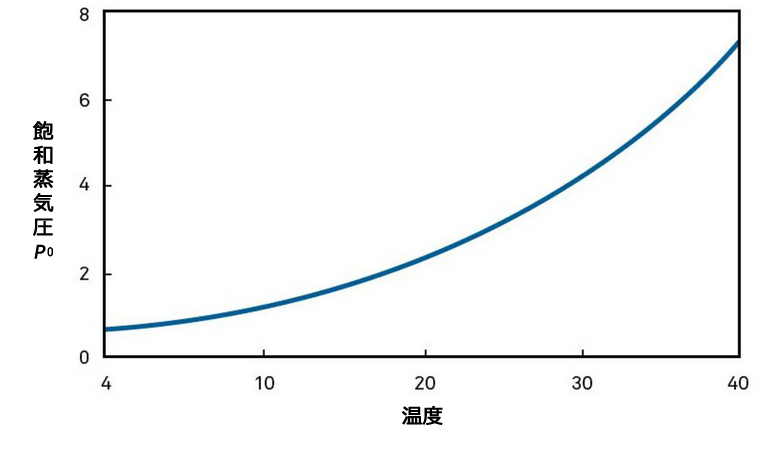
一次測定法とは、直接測定、校正不要
露点法(またはチルドミラー露点法)の大きな利点は、測定速度が速く精度が高いことです。チルドミラー露点センサーは、基本的な熱力学の原理に基づいた一次的測定法です。チルドミラー露点式水分活性測定装置は、通常5分以内に高精度(±0.003aw)の測定を行うことができます。水分活性の測定は測定温度に基づくため、校正は必要ありません。ユーザーは標準塩溶液を測定し、規格通りの測定精度が出ているかを定期的に確認するだけです。一次的測定方法である露点式は迅速な測定が可能なため、水分活性の測定によるベルトコンベアの速度や加熱時間、温度の調整が、製造ラインでできるようになります。
市場で最も高速かつ高精度な水分活性測定法であることが文献に示されているのが、このチルドミラー露点法ですが、それを採用しているのがAquaLab4TEです。その仕組みは動画でご覧ください。
政府の規制は水分活性の使用を推奨
米国食品医薬品局(FDA)は、水分活性を安全規制に組み入れました。これらの規制は、製品が衛生的な条件の下で製造され、純粋で健康によく、かつ安全であることを保証するための特定の要件と実施要領を詳述しています。以下の表は、水分活性の使用を推奨する米国政府の安全規制の参考資料です。
| 機関 | 製品の種類 | レファレンス番号 | 最終更新日 | 概説 |
|---|---|---|---|---|
| FDA(米国食品医薬品局) | 食品 | FSMA Sec.103 | 2016/12/5 | 予防措置と安全に対するリスクベースのアプローチについて説明し、予防的管理の監視の必要性を指摘しているが、水分活性については特に言及していない |
| FDA | 食品 | 21 CFR パート117 | 2012/5/16 | ハザード分析及びリスクベースの予防的管理の実践を概説し、水分活性等の検査のモニタリングの実践を含む(水分活性には特に言及しない) |
| FDA | 食品 | 2013年食品コード | 2017 | 食品基準は、新しい FSMA 規制の一部として、ハザードおよび予防的管理方法を決定するためのガイドとし て機能する。2017年の食品基準の「安全な食品のための時間/温度管理」にあるように、潜在的なリスクを持つ食品の定義は、awとpHに基づき、相互作用表AおよびBを使用している |
| FDA | 食品 | 21 CFR パート 113 | 2016/1/16 | 熱処理食品は、0.85aw以下であれば細菌生育の影響を受けないと説明されているが、これは2013年の食品コードの情報に取って代わられた古い基準である |
| FDA | 食品 | 21 CFR パート 110.8 | 2015/4/4 | この項の製造業務(2)で概説されているGMPは、製品の水分活性を監視して安全なレベルに保たれていることを確認することでGMPを検証することができると示されている |
| USDA(米国農務省) | RTEミート(そのままで食すことができる肉) | 一般的なHACCPモデル10 | 2005/2/5 | 水分活性が乾燥工程を監視する適切な方法であり、特に水分-タンパク質比の代わりとなることを確認している |
| USDA | RTEミート | ジャーキーの法令遵守ガイドライン(小規模工場含) | 2014/5/27 | 製品が重要な管理点を満たしていることを証明するために水分活性を確認する必要性を示し、カビを制御するために0.70awより低い値を推奨しているが、0.85awの水分活性レベルにも言及している |
| USDA | RTEミート | リステリア菌の管理に関する法令遵守ガイドライン | 2014/01 | 製品がリステリア菌に感染していないことを確認するための選択肢として、菌の生育を防ぐための屠殺後処理(水分活性はこの目的に使用できるが、特に言及はしていない)について説明している |
| USP(米国薬局方) | 医薬品 | USP 922 | 2021/05 | 水分活性測定を行うためのガイダンスと方法を提供。機器の適格性確認と校正の方法を規定。結果を報告するためのガイダンスを提供している |
| USP | 医薬品 | USP 51 | 2016/5/1 | 微生物試験法では、試験が水分活性0.60aw以上の製品のみを対象としていることに言及し、USP1112を参照 |
| ICH(日米欧医薬品規制調和国際会議) | 医薬品 | Q6Aデシジョンツリー6及び8 | 1999/10 | 製品が本質的に乾燥していて、微生物の生育を促進しない場合には、その科学的証拠を示せば、微生物限度試験は必要ない場合があると言及 |
| ISO(国際標準化機構) | 化粧品 | ISO 2961 | 2010/6/1 | 微生物学的に低リスクの製品のリスク評価と識別のためのガイドライン-水分活性について多くの言及がある |
水分活性による賞味期限の簡略化
製品固有の正確な賞味期限がなければ、まだ食べられる賞味期限切れの製品を廃棄することになりかねません。あるいは、賞味期限内でも実際にはもう食べられない製品を販売してしまうこともあります。また、役に立たない包装に高いお金を払っている可能性もありますし、逆に、包装を改善すれば確保できたはずの保存期間を大幅に短縮している可能性もあります。これは要するに、確かなことがわからない中、暗闇の中で仕事をしているようなものなのです。
では、なぜ人々はもっと賞味期限の検査を行わないのでしょうか?
典型的な理由は、妥協のない本格的な賞味期限検査は困難な作業を伴うからです。湿気や温度、不良モード など、複雑な関係が絡んできます。
カビ、微生物の生育、腐敗、食感や風味の変化、ビタミンの劣化など、さまざまな要因が製品の安全性を損ねたり、口当たりを悪くしたりする可能性があります。ほとんどの人は、本格的な賞味期限試験を社内で行う専門知識を持っていませんし、外部の研究所に依頼すると高額になります。
このような賞味期限試験に代わるものとして、科学的根拠に裏付けられた方法があります。それは、水分活性によって単純化された賞味期限です。これは、誰でも、たとえ小さなスタートアップ企業でも実施可能な試験で、製品の賞味期限を予測するために必要なすべてのデータを生成します。
賞味期限と水分活性
水分活性で賞味期限を単純化するとはどういうことでしょうか?
- それは、余分なものを排除することです。製品の水分活性がわかれば、その製品でどの 不良モード が問題なのかがわかります。
- 水分活性で賞味期限の予測が簡単になります。水分活性計と他の測定方法(特定の不良モードによって異なる)を使って、簡単な社内試験を行い、賞味期限を正確に予測することができます。
- 製造の標準化。水分活性の仕様を設定することで、バッチごとに最適な賞味期限を達成することができます。
賞味期限データは、製品不良の防止、賞味期限の予測や延長、最も費用対効果の高い包装の選択などに役立つ貴重な情報を与えてくれます。
賞味期限を終了させる要因
賞味期限に影響を与える主な要因は、微生物の特性、化学的変化、物理的劣化の3つです。これらの要因はすべて、水分活性に関連しています。
微生物の生育
微生物には、生育できない限界の水分活性があります。水分活性は水分含量ではなく、微生物の生育に「利用できる」水の下限を決定します。細菌、イースト菌、カビは生育を維持するために一定量の「利用可能な」水を必要とするので、限界水分活性値以下の製品を設計することは、生育をコントロールするための効果的な手段となります。
製品に含まれる水の量が多くても、そのエネルギーレベルが十分に低ければ、微生物は生育に必要な水を得ることができません。この「砂漠のような」状態は、微生物とその周辺の環境との間に浸透圧の不均衡を生じさせます。その結果、微生物は生育できなくなるのです。
カビや微生物の生育は、保存期間にとって最大の脅威となります。水分活性をコントロールすることで、微生物の生育を抑制・防止し、保存期間を延ばし、冷蔵せずに安全に保存できる製品もあります。明確に定義された表を使用することで、製品の水分活性の限界を設定し、これを賞味期限試験に使用することができます。
| aw | 細菌 | カビ | 酵母 | 代表的な食品 |
|---|---|---|---|---|
| 0.97 | ボツリヌス菌 E型 (Clostridium botulinum E ) シュードモナス・フルオレッセンス (Pseudomonas fluorescens) |
生肉、果物、野菜、果物や野菜の缶詰 | ||
| 0.95 | 大腸菌 ウェルシュ菌 (Clostridium perfringens) サルモネラ属菌 (Salmonella spp.) コレラ菌 (Vibrio cholerae) |
減塩ベーコン、調理したソーセージ、点鼻薬、目薬 | ||
| 0.94 | ボツリヌス菌 A型、B型 (Clostridium botulinum A, B) 腸炎ビブリオ菌 (Vibrio parahaemolyticus) |
糸状菌 (Stachybotrys atra) |
||
| 0.93 | セレウス菌 (Bacillus cereus |
糸状菌 (Rhizopus nigricans) |
一部のチーズ、生肉(ハム)、ベーカリー製品、 エバミルク、外用ローション |
|
| 0.92 | リステリア菌 (Listeria monocytogenes) |
|||
| 0.91 | 枯草菌 (Bacillus subtilis) |
|||
| 0.90 | 嫌気性 黄色ブドウ球菌 (Staphylococcus aureus) |
バラ色カビ病菌 (Trichothecium roseum) |
出芽酵母 (Saccharomyces cerevisiae) |
|
| 0.88 | カンジダ菌(Candida) | |||
| 0.87 | 好気性 黄色ブドウ球菌 (Staphylococcus aureus) |
|||
| 0.85 | アスペルギルス・クラバタス (Aspergillus clavatus) |
加糖練乳、熟成チーズ(チェダーチーズ)、 発酵させたソーセージ(サラミ)。 乾燥肉(ジャーキー)、ベーコン、ほとんどの濃縮果汁、 チョコレートシロップ、フルーツケーキ、フォンダン、 咳止めシロップ、経口鎮痛剤懸濁液 |
||
| 0.84 | 耐熱性カビ (Byssochlamys nivea) |
|||
| 0.83 | ペニシリウム属菌 (Penicillium expansum、Penicillium islandicum, Penicillium viridicatum ) |
デハリモセス・ハンセニー (Deharymoces hansenii) |
||
| 0.82 | アスペルギルス属菌 (Aspergillus fumigatus、Aspergillus parasiticus) |
|||
| 0.81 | ペニシリウム属菌 (Penicillium、Penicillium cyclopium、Penicillium patulum) |
|||
| 0.80 | サッカロマイセス・バイリ (Saccharomyces bailii) |
|||
| 0.79 | ペニシリウム・マルテンシ (Penicillium martensii) |
|||
| 0.78 | アスペルギルス・フラバス (Aspergillus flavus) |
ジャム、マーマレード、マジパン、グラッセフルーツ、 糖蜜、ドライイチジク、魚の塩漬け |
||
| 0.77 | アスペルギルス属菌 (Aspergillus niger、Aspergillus ochraceous) |
|||
| 0.75 | アスペルギルス属菌 (Aspergillus restrictus、Aspergillus candidus) |
|||
| 0.71 | ユーロティウム・シェヴァリエリ (Eurotium chevalieri) |
|||
| 0.70 | ユーロティウム・アムステロダミ (Eurotium amstelodami) |
|||
| 0.62 | サッカロマイセス・ローキシィ (Saccharomyces rouxii) |
ドライフルーツ、コーンシロップ、甘草、マシュマロ、 チューインガム、乾燥ペットフード |
||
| 0.61 | モナスカス・ビスポラス (Monascus bisporus) |
|||
| 0.60 | 微生物生育なし | |||
| 0.50 | 微生物生育なし | キャラメル、タフィー、蜂蜜、麺類、外用軟膏 | ||
| 0.40 | 微生物生育なし | 全卵粉、ココア、液体咳止め | ||
| 0.30 | 微生物生育なし | クラッカー、でんぷん系スナック、ケーキミックス、ビタミン剤、座薬 | ||
| 0.20 | 微生物増殖なし | ゆで菓子、粉ミルク、乳児用粉ミルク |
化学的劣化
水は溶媒として働き、それ自身が反応物となり、また粘性によって反応物の移動性を変化させることができるため、水分活性は化学反応の劣化速度に影響を及ぼします。例えば、非酵素的な褐変反応は水分活性の増加とともに増加し、0.6awから0.7awで最大となり、脂質の酸化は約0.2awから0.3awで最小になります。最適な化学的安定性は、一般に収着等温線から求めた単層水分含量の近傍に見られます。
物理的劣化
高湿度および低湿度環境は、製品の水分活性に影響を与え、製品のテクスチャーや物理的特性に好ましくない変化をもたらし、保存期間を短縮させることがあります。乾燥した製品ではパリッとした食感が失われ、粉末では固形化、湿った製品では硬さや噛みごたえが失われるなどの問題があります。製品の臨界水分活性を特定するたためにはある程度の研究が必要ですが、これも水分活性をの概念を用いることで容易に行うことができます。

包装、出荷、保管
出荷時および保管時の水分活性の変化は、保存期間に大きな影響を与えます。水分活性は温度に依存し、出荷時や保管時の温度はパッケージ内の水分活性に影響を与えます。簡素化された賞味期限試験は、最適な包装を決定し、出荷・保管条件が製品の賞味期限に及ぼす影響を評価するのに役立ちます。
等温線が水分活性の最適値を特定する
製品の経時変化を予測する
食品メーカーは、製品がカビたり、水っぽくなったり、古くなったり、腐ったり、固まったり、結晶化したり、消費者が受け入れられなくなるまでにどれくらいの時間がかかるかを知っておく必要があります。収着等温線は、製品の賞味期限を予測し、延長するための強力なツールです。これによって次のことが可能になります。
- 固結、食感の低下などの変化が生じる臨界水分活性値を求める
- 成分や配合の変更に対して製品がどのように反応するかを予測する
- 賞味期限を正確に予測する
- 混合モデルを作成する
- 包装計算を実行する
- 単層値(製品が最も安定する値)を特定する
等温線:製品配合の究極の理想
収着等温線とは、一定温度に保たれた製品に水を吸着・脱着させると、水分活性(aw)がどのように変化するかを示すグラフです。この関係は複雑で、製品ごとに異なります。水分活性はほとんどの場合、水分の増加に伴って上昇しますが、その関係は直線的ではありません。実際、水分収着等温線はほとんどの食品でS字型(シグモイド型)、結晶性物質や高脂肪分を含む食品ではJ字型になります。
手作業による等温線作成は非実用的
等温線を作成する古典的な方法は、特定の水分活性値に調整された塩溶液を入れたデシケーターに、試料の重量変化が止まるまで試料を入れることです。その後、試料の重量を測定し、水分含量を決定します。各試料は等温曲線上の1点を生成します。
このプロセスは非常に時間がかかるため、従来は5~6点のデータを使って、GABやBETのような曲線適合式で曲線を作成していました。
等温線作成の高速化
収着等温線を手作業で作成するのは骨が折れます。そのため自動化が必要でした。最初に使われた方法で現在でもほとんどの蒸気収着装置で使われている方法は、DVS(動的水蒸気収着法)と呼ばれるものです。試料を湿度調整された空気の流れにさらし、試料が水を吸着・脱着する際の重量のわずかな変化を精密天秤で測定します。平衡状態になると、装置は予め設定された次の湿度レベルに動的に移行します。分析には2日から数週間かかります。
DVS法は、製品が特定の湿度にさらされたときに何が起こるか、どの程度の速さで水を吸着または放出するかという収着の動力学を調べるのに適しています。しかし、DVS法は、1回の平衡ステップで等温曲線上の1点のみを生成するため、高解像度の等温曲線を作成するのにはあまり役立ちません。
DDI法で、これまでにわからなかったことが明らかになる
このDVS法の問題を解決するために開発されたのが、DDI法(動的露点等温線法)です。試料を加湿または乾燥させた空気にさらしながら、水分活性と水分含量を5秒ごとに測定し、吸着・脱着曲線の詳細を示す高分解能の等温線を作成します。DDIのグラフには数百のデータポイントが含まれ、固結、潮解、テクスチャーの消失が起こる臨界点など、これまで見えなかった詳細が表示されます。
等温線の作成方法
AquaLab VSA 水分吸脱着測定装置は、高速かつ高解像度の DDI および DVS 等温線グラフを自動で作成することができ、製品への理解が一変します。デュアルテストモードと洗練されたモデリングソフトウェアにより、優れた製品の製造、モニタリング、保管、出荷に必要なソリューションへとデータを変換します。
等温線データをソリューションに変える
VSAには、感覚的に操作できて使いやすい、フル機能のモデリング・ソフトウェア「Moisture Analysis Toolkit」が付属しています。 このソフトは研究により実証された予測モデルを使用して、データをソリューションへと変換する方法を示します。必要なすべてのモデルが1つの場所にあり、使いやすいプログラムにまとめられています。ガラス転移の臨界湿度の特定、包装性能の評価、吸湿性の判定、ヒステリシスの追跡、コーティング破壊の予測、固結しやすさの特定など、さまざまなことが可能です。
等温線から臨界水分活性を特定
あるスプレードライ粉乳の製造業者のケースですが、包装を二重にして厳格な保管温度の指針を作成したにもかかわらず、粉乳が固結してしまいました。
ガラス転移が問題になる場合
牛乳をスプレードライすると、急速な蒸発により糖類がガラス状になります。ガラス状の乳糖は、結晶性の乳糖とは全く異なる性質を持っています。可動性が低いため、粉末がガラス状である間は粒子同士が固結することはありません。結晶構造はより低いエネルギー状態なので、ガラス状から結晶に移行する分子が必ず存在します。問題は、転移速度が転換点に達したときに発生します。
水分活性から転移速度を予測する
水分活性が0.30awであれば、すべての乳糖が結晶化するのに数年かかるかもしれません。0.40awの場合、1ヶ月で結晶化します。0.43aw以上では、数時間で転移が起こります。乳糖が結晶化すると、粉ミルクは恒久的に変化します。水分の保持量が劇的に変わり、溶けなくなり、味が悪くなります。要するに、製品がダメになってしまうのです。
DDI等温線はガラス転移点を予測する
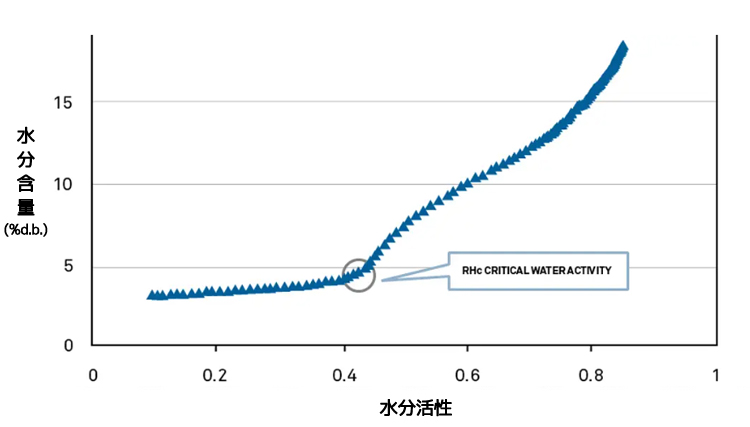
スプレードライ粉乳のような粉末製品のガラス転移点は、高分解能のDDI等温線を用いて見極めることができます。従来のDVS等温線は、測定ポイントが少ないため、ポイント間を埋めて等温線を作成するためにモデルに依存しています。DDI等温線は数百のポイントを測定するので、スプレードライ粉乳のガラス転移点のような転移を特定することができます。
等温線の二階微分プロットのピーク値から、臨界相変化水分活性値は0.43awであることが確認されました。
こうしてこの食品メーカーは、製造ラインにおいて厳密な制御値を用いて正確な検査を定期的に実施し、製品の出荷前検査の合格率を改善することができました。
混合モデルの作成
あるケーキメーカーが、クリーム入りのケーキのレシピを考案していました。レシピの構成要素は、フロスティング(水分約7%)、クリームフィリング(12%)、ケーキ(15%)でした。過去には、保存期間中に水分移動が発生し、ケーキが硬くなったり、フロスティングがゴム状になったり、液化したクリームフィリングがケーキに滲み込んだりするといった食感に関わるの問題が発生していました。
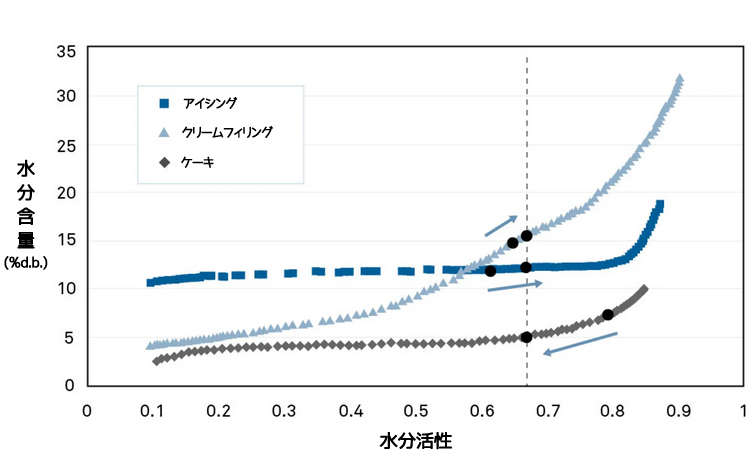
材料間でどのように水分が移動するかを見極める
各材料の水分収着等温線から、最も乾燥した材料(水分含量7%)のフロスティングの水分活性が、0.79awと最も高いことがわかりました。クリームとケーキの水分活性は、それぞれ0.66awと0.61awとほぼ同じでした。
最終製品の水分活性を予測する
等温線をカイプロットに変換すると、最終製品の水分活性は0.67awとなりました。これはケーキの水分活性値としては微生物的に安全な値です。
不測の事態を避ける
そこでこのケーキメーカーは、安全を確保するために平衡水分活性(0.67aw)でケーキを焼き上げ、味覚テストを行うことに成功しました。
包装の選択
1回分の粉末飲料ミックスの市場は拡大を続けているセグメントです。この製品の原材料コストの50%以上を占めるのが包装です。包装の主な目的は、目標とする賞味期限にわたり、ドリンクミックスを臨界水分活性以下に維持することです。
包装設計の計算は、臨界水分活性値から始まります。動的露点等温線(DDI)から正確な値を得ることができるため、この種の包装設計の計算が可能になります。
この曲線は、ある粉末飲料ミックスのガラス転移点を示しています。
この粉末飲料ミックスの臨界水分活性(正確な変曲点)は、温度25℃のときの0.618awです。
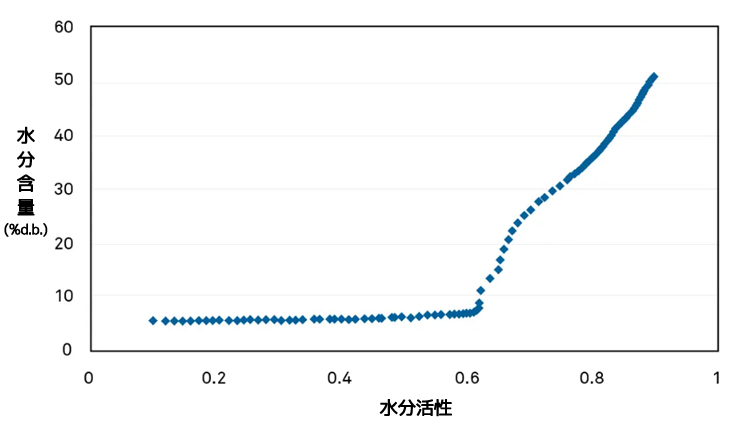
包装のコンダクタンスを計算する
ソフトウェアツールとしても利用できる合理化されたパッケージ計算が『Fundamentals of Isotherms 』に収録されています。それを使用して、この飲料ミックスの 4 種類の包装(最初の包装と 3 種類の代替案)を評価しました。湿度の高い条件下(25℃、湿度75%)での結果は以下のとおりです。
配合の変更を理解する
あるペットフード会社は、水分活性によって微生物を制御する防腐剤フリーの製品を製造するために、配合を変更しました。その製品を導入して間もなく、腐敗による返品が発生し始めました。
最初の評価では、腐敗の予測は非常に低い温度(15℃)で行われた水分活性試験に基づいていました。15℃、25℃、40℃で等温線を作成したところ、(ペットフードではよくあることですが)過酷な条件下で保管すると、腐敗する可能性があることがわかりました。
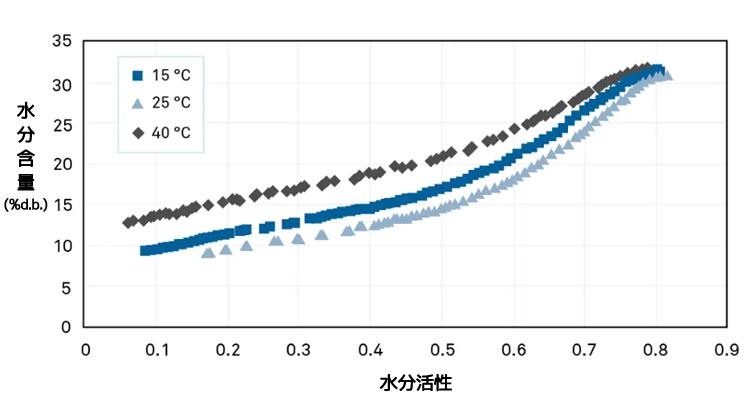
等温線により完全な予測が可能となり、この会社は配合を見直すことにより問題を解決することができました。
不良品を調査する
あるピーカン生産者は、13年にわたり問題が発生したことはありませんでしたが、製品にカビの問題が発生し、不合格と判定されてしまいました。そこで、この問題を調査するために等温線が作成されました。
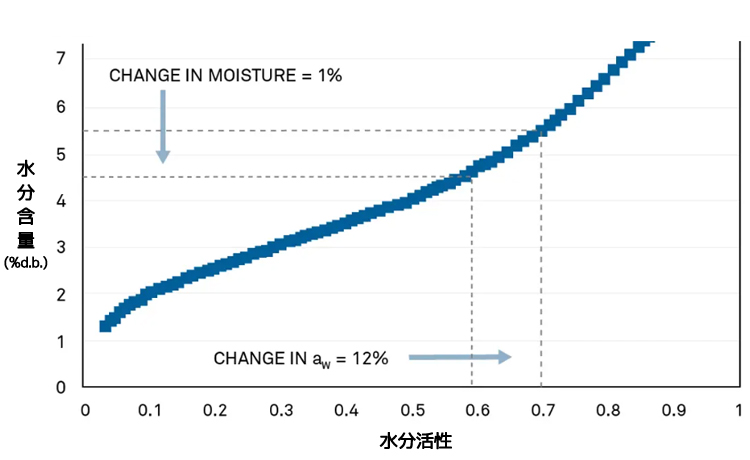
微生物の生育を防ぐために、ピーカンは0.60awまで乾燥させる必要があります。等温線が示すように、水分活性0.60awのときのピーカンの水分含量は4.8%です。また、ピーカンの等温線はこの重要な制御領域において傾きが小さいため、わずかな水分含量の変化であっても水分活性が大きく変化し、微生物が生育できる危険な状態になるのです。
等温線により、規格が低すぎたことが判明
完全な等温線を作成することによって、このピーカン生産者の製造工程がピーカンの安全性と品質を保証するのに十分でなかったことが明らかになりました。彼らが加熱乾燥法により測定した水分含量は5%でしたが、その測定精度が±0.5%であったことから、実際の水分含量は4.5~5.5%であったかもしれないのです。
したがって、高湿度下での保管や不適切な包装など、あらゆる要因がピーカンの水分活性を危険な値まで押し上げ、腐敗の原因となった可能性があります。
動的露点等温線(DDI)を用いた研究
Allan, Matthew, and Lisa J. Mauer. “Comparison of methods for determining the deliquescence points of single crystalline ingredients and blends.” Food Chemistry 195 (2016): 29-38. doi:10.1016/j.foodchem.2015.05.042.
Allan, Matthew, Lynne S. Taylor, and Lisa J. Mauer. “Common-ion effects on the deliquescence lowering of crystalline ingredient blends.” Food Chemistry 195 (2016): 2-10. doi:10.1016/j.foodchem.2015.04.063.
Barry, Daniel M., and John W. Bassick. “NASA Space Shuttle Advanced Crew Escape Suit Development.” SAE Technical Paper Series, 1995. doi:10.4271/951545.
Bonner, Ian J., David N. Thompson, Farzaneh Teymouri, Timothy Campbell, Bryan Bals, and Jaya Shankar Tumuluru. “Impact of Sequential Ammonia Fiber Expansion (AFEX) Pretreatment and Pelletization on the Moisture Sorption Properties of Corn Stover.” Drying Technology 33, no. 14 (2015): 1768-778. doi:10.1080/07373937.2015.1039127.
Carter, B.P., Galloway, M.T., Campbell, G.S., and Carter, A.H. 2016. Changes in the moisture permeability of grain at the critical water activity from dynamic dew point isotherms. Transactions of the ASABE. 59(3):1023-1028.
Carter, B.P., Galloway, M.T., Morris, C.F., Weaver, G.L., and Carter, A.H. 2015. The case for water activity as a specification for wheat tempering and flour production. Cereal Foods World 60(4):166-170.
Carter, Brady P., Mary T. Galloway, Gaylon S. Campbell, and Arron H. Carter. “The critical water activity from dynamic dew point isotherms as an indicator of crispness in low moisture cookies.” Journal of Food Measurement and Characterization 9, no. 3 (2015): 463-70. doi:10.1007/s11694-015-9254-3.
Carter, Brady P., Mary T. Galloway, Gaylon S. Campbell, and Arron H. Carter. “The critical water activity from dynamic dew point isotherms as an indicator of pre-mix powder stability.” Journal of Food Measurement and Characterization 9, no. 4 (2015): 479-86. doi:10.1007/s11694-015-9256-1.
Carter, B.P and S.J. Schmidt. 2012. Developments in glass transition determination in foods using moisture sorption isotherms. Food Chemistry 132:1693-1698.
Coronel-Aguilera, Claudia P., and M. Fernanda San Martín-González. “Encapsulation of spray dried β-carotene emulsion by fluidized bed coating technology.” LWT – Food Science and Technology 62, no. 1 (2015): 187-93. doi:10.1016/j.lwt.2014.12.036.
Fonteles, Thatyane Vidal, Ana Karoline Ferreira Leite, Ana Raquel Araújo Silva, Alessandra Pinheiro Góes Carneiro, Emilio De Castro Miguel, Benildo Sousa Cavada, Fabiano André Narciso Fernandes, and Sueli Rodrigues. “Ultrasound processing to enhance drying of cashew apple bagasse puree: Influence on antioxidant properties and in vitro bioaccessibility of bioactive compounds.” Ultrasonics Sonochemistry 31 (2016): 237-49. doi:10.1016/j.ultsonch.2016.01.003.
Hao, Fayi, Lixin Lu, and Jun Wang. “Finite Element Analysis of Moisture Migration of Multicomponent Foods During Storage.” Journal of Food Process Engineering 40, no. 1 (2016). doi:10.1111/jfpe.12319.
Hao, Fayi, Lixin Lu, and Jun Wang. “Finite Element Simulation of Shelf Life Prediction of Moisture-Sensitive Crackers in Permeable Packaging under Different Storage Conditions.” Journal of Food Processing and Preservation 40, no. 1 (2015): 37-47. doi:10.1111/jfpp.12581.
Kuang, Pengqun, Hongchao Zhang, Poonam R. Bajaj, Qipeng Yuan, Juming Tang, Shulin Chen, and Shyam S. Sablani. “Physicochemical Properties and Storage Stability of Lutein Microcapsules Prepared with Maltodextrins and Sucrose by Spray Drying.” Journal of Food Science 80, no. 2 (2015). doi:10.1111/1750-3841.12776.
Liu, Wei, Haifeng Wang, Xifeng Gu, Can Quan, and Xinhua Dai. “Certification of reference materials of sodium tartrate dihydrate and potassium citric monohydrate for water content.” Anal. Methods 8, no. 13 (2016): 2845-851. doi:10.1039/c5ay03067f.
Marquez-Rios, E., V.m. Ocaño-Higuera, A.n. Maeda-Martínez, M.e. Lugo-Sánchez, M.g. Carvallo-Ruiz, and R. Pacheco-Aguilar. “Citric acid as pretreatment in drying of Pacific Lion's Paw Scallop (Nodipecten subnodosus) meats.” Food Chemistry 112, no. 3 (2009): 599-603. doi:10.1016/j.foodchem.2008.06.015.
Penner, Elizabeth A., and Shelly J. Schmidt. “Comparison between moisture sorption isotherms obtained using the new Vapor Sorption Analyzer and those obtained using the standard saturated salt slurry method.” Journal of Food Measurement and Characterization 7, no. 4 (2013): 185-93. doi:10.1007/s11694-013-9154-3.
Rao, Qinchun, Mary Catherine Fisher, Mufan Guo, and Theodore P. Labuza. “Storage Stability of a Commercial Hen Egg Yolk Powder in Dry and Intermediate-Moisture Food Matrices.” Journal of Agricultural and Food Chemistry 61, no. 36 (2013): 8676-686. doi:10.1021/jf402631y.
Rao, Qinchun, Andre Klaassen Kamdar, Mufan Guo, and Theodore P. Labuza. “Effect of bovine casein and its hydrolysates on hardening in protein dough model systems during storage.” Food Control 60 (2016): 621-28. doi:10.1016/j.foodcont.2015.09.007.
Syamaladevi, Roopesh M., Ravi Kiran Tadapaneni, Jie Xu, Rossana Villa-Rojas, Juming Tang, Brady Carter, Shyam Sablani, and Bradley Marks. “Water activity change at elevated temperatures and thermal resistance of Salmonella in all purpose wheat flour and peanut butter.” Food Research International 81 (2016): 163-70. doi:10.1016/j.foodres.2016.01.008.
Wei, Meilin, Xiaoxiang Wang, Jingjing Sun, and Xianying Duan.“A 3D POM–MOF composite based on Ni(ΙΙ) ion and 2,2′-bipyridyl-3,3′-dicarboxylic acid: Crystal structure and proton conductivity.” Journal of Solid State Chemistry 202 (2013): 200-06. doi:10.1016/j.jssc.2013.03.041.
Wei ML, Sun JJ, Wang XJ “Preparation and proton conductivity evaluation of a silicate gel composite doped with a metal–Schiff-base–POM-MOF.”Journal of Sol-Gel Science and Technology 71, no. 2 (2014): 324-28. doi:10.1007/s10971-014-3370-0.
Yuan, X., Carter, B.P. and Schmidt, S.J. 2011. Determining the Critical Relative Humidity at which the Glassy to Rubbery Transition occurs in Polydextrose using an Automatic Water Vapor Sorption Instrument. Journal of Food Science 76(1): E78-89.
Zabalaga, Rosa F., Carla I.a. La Fuente, and Carmen C. Tadini. “Experimental determination of thermophysical properties of unripe banana slices (Musa cavendishii) during convective drying.” Journal of Food Engineering 187 (2016): 62-69. doi:10.1016/j.jfoodeng.2016.04.020.
付録
水分活性と水分含量の比較
水分活性は、水分含量よりも複雑な測定方法を伴うと思われがちです。しかし、正確で再現性のある水分含量測定を行うことは、見た目ほど簡単なことではありません。
理論的には、水分含量の測定は簡単です。製品に含まれる水分量を測定し、それを製品に含まれる他のすべてのものの重量と比較するだけです。しかし実際には、製品に含まれる水分の正確な割合を求めるのは難しく、複雑なプロセスです。その理由は以下の通りです。
報告方法の違いによる混乱
水分の含有量は、湿量基準または乾燥基準で報告されます。湿量基準では、水分量を試料の総重量(固形分と水分)で割ります。乾燥基準では、水分量を乾燥重量(固形分のみ)で割ります。残念ながら、水分含量はパーセンテージで報告されることが多く、どちらの方法で測定されたかは明らかにされていません。湿量基準と乾燥基準の換算は容易ですが、異なる基準で報告された水分含量を比較すると、混乱と潜在的な問題が発生します。さらに、乾燥基準で報告された水分含量は、実際には100%より大きい値となり、さらなる混乱を引き起こす可能性があります。
測定方法が多様であるため比較ができない
AOACは35種類の異なる水分含量測定方法を挙げています。これらは直接法と間接法に分類されています。直接法では、(乾燥、蒸留、抽出などにより)製品から水分を除去し、計量または滴定により水分含量を測定します。直接法は最も信頼性の高い結果を得ることができますが、通常、労力と時間がかかります。例えば、オーブン乾燥、真空オーブン乾燥、凍結乾燥、蒸留、カールフィッシャー、熱重量分析、化学的乾燥、ガスクロマトグラフィーなどがあります。
間接法では、試料から水分を取り除くことはしません。その代わり、水分量の変化に応じて変化する食品の特性を測定します。これらの方法は、一次法または直接法への修正が必要です。その精度は、一次法の精度によって制限されます。間接法は通常、迅速で試料の準備もほとんど必要ありませんが、直接法よりも信頼性が低くなります。間接法の例としては、屈折法、IR吸収法、NIR吸収法、マイクロ波吸着法、誘電容量法、導電率法、超音波吸収法などがあります。
さらに、ある測定方法と別の測定方法が同じ結果をもたらすとは限りません。通常、測定方法は水分含量値とともに報告されませんから、これも水分含量測定のプロセスを複雑にしています。
直接測定する方法であっても、一貫した結果が得られるとは限りません。試料を加熱する必要がある方法(加熱乾燥法など)は、有機揮発成分の損失や試料の分解(特に糖分を多く含む試料の場合)につながる可能性があります。例えば、試料中に有機揮発成分が含まれていたり、乾燥中に試料が分解したりすると、揮発成分の損失や分解の影響を受けにくいカールフィッシャー分析と加熱乾燥分析では結果が異なります。
ばらつきの回避が難しい
これらの問題に対する一つの答えは、単純に一貫した方法を用いて、同じ方法で得られた値だけを比較することです。しかし、水分分析の測定方法を統一しても、すべての問題が解決されるわけではありません。たとえば、加熱乾燥法について考えてみましょう。この方法は簡単そうに見えます。試料の重量を測定し、その重量を記録します。次に試料をオーブンに移して乾燥させ、乾燥後の重量を測定します。そして、最初の重量から乾燥後の重量を引いて水分量を求め、水分量を乾燥重量または総重量で割ったものを水分含量とします。
この単純な加熱乾燥法にさえも、潜在的な変動の罠が潜んでいます。最も基本的なものは、「乾燥」という用語が実際の科学的意味を持たず、これまでうまく定義されてこなかったことです。その代わりに、再現性のある任意の乾燥度を各試料に設定する必要があります。「乾燥度」は、重量減少が終了した時点と定義されることが多いのですが、熱重量測定グラフを見ると、製品ごとに異なる温度で重量減少が頭打ちになることがわかります。また、製品によって乾燥に要する時間が異なり、ある製品では乾燥する温度でも、別の製品では分解することがあります。つまり、試料ごとに理想的な乾燥温度と乾燥時間が存在するのです。この理想的な時間と温度の組み合わせは、製品によっては文献で確認することができますが、確認できないものも多くあります。未試験の製品にどのような組み合わせを使用すればよいかを知ることは困難です。同じ時間・温度の組み合わせを使用しない場合、得られた水分含量を比較するべきではありません。
また多くのオーブンが、時間の経過とともにその誤差が15℃にもなり、2つのオーブンを同じ温度に設定して稼働しても40℃も差が出ることがあるのも複雑な点です。
さらに、加熱乾燥法だけでも、オーブンの蒸気圧、試料の調製方法、試料の粒径、試料の重量、乾燥後の処理などが変動要因として挙げられます。興味深いことに、このような潜在的な落とし穴があるにもかかわらず、文献上では加熱乾燥法により水分含量が報告されると、それが直ちに正しいものとして受け入れられています。また、水分含量測定法間の比較で、いずれかの測定法が加熱乾燥法法である場合、常に加熱乾燥法の測定が正しいものとされています。
乾燥とは?
「乾燥」を定義することは、水分含量測定に関連するいくつかの矛盾を解消するのに役立つと思われます。乾燥の定義に最も適しているのは、加熱乾燥の水分活性を特定することです。乾燥重量は、その加熱乾燥水分活性を達成したときの試料の重量となります。一般的な環境条件である25℃、湿度30%の環境下では、95℃に設定されたオーブンは、オーブン内の蒸気圧が大気と同じであると仮定すると、0.01awの加熱乾燥水分活性を発生させることになります。環境条件に関わらず、加熱乾燥水分活性が常に0.01awである状態を維持するオーブンは、科学的に「乾燥」した状態を作り出すことになります。このようなオーブンでは、製品の重量が変化しなくなったときに乾燥したと宣言することができます。水分活性は0.01awとなり、その重量が乾燥重量となります。水分活性が0.01awに保たれていれば、揮発性物質を放出しないようにオーブンの蒸気圧と温度を調整することも可能です。この方法を用いれば、複数の測定方法が存在すること、および 「乾燥 」の定義が不明確なために生じる矛盾を解消することができます。
より正確な水分分析
水分含量は歩留まりや数量に関する貴重な情報であり、金銭的な観点からも重要です。また、水分が多いほど流動性が増し、ガラス転移温度が低くなるため、食感に関する情報も得られます。しかし、正確で一貫性のある水分含量の値を得ることは難しく、水分含量の測定は、その値を得るために使用された方法についての情報がなければ、額面通りに受け取ることはできません。また、製品の一貫性、品質、微生物的安全性など、製品中の水分含量が実際には語れないことを語るために使われる場合にも、さらなる問題が生じます。このような場合、水分活性はより正確な測定値です。完全な水分分析のためには、食品および医薬品の開発者は水分含量と水分活性の両方を測定する必要があります。さらに、収着等温線を用いて、最適な保存期間、食感、安全性、品質を達成・維持できる場所をピンポイントで特定することもできます。
水分活性の科学的定義
水分活性は、熱力学と物理化学の基本原理から導かれます。熱力学の原理として、水分活性の定義には満たさなければならない要件があります。その要件とは、純水(aw = 1.0)を基準状態とし、システムが平衡状態にあり、温度が定義されていることです。
平衡状態において
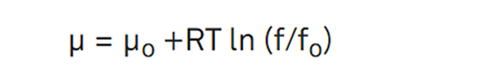
ここで、μ (J mol-1) はシステムの化学ポテンシャル、すなわち物質 1 モル当たりの熱力学的活性またはエネルギー、μo は温度 T (°K) における純物質の化学ポテンシャル、R は気体定数 (8.314 J mol-1 K-1) 、f は物質のフガシティまたは脱離傾向、fo は純物質の脱離傾向です (van den Berg と Bruin、1981)。種の活性は、a = f/fo で定義されます。水を扱う場合、下付き文字はその物質を指定します。

awは水分活性、またはシステム内の水の蒸発傾向を曲率半径のない純水の蒸発傾向で割ったものです。実用的には、食品が存在するほとんどの条件下で、フガシティは蒸気圧(f ≈ p)で近似されるため、以下のようになります。
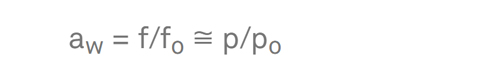
μがシステムのどこででも同じであるとき、そのシステムで平衡が得られます。液相と気相の平衡は、μが両相で同じであることを意味します。この事実があるからこそ、気相の測定で試料の水分活性を決定することができるのです。
水分活性は、ある物質中の水の蒸気圧(p)と、同じ温度での純水の蒸気圧(po)の比と定義されます。空気の相対湿度は、空気の蒸気圧とその飽和蒸気圧の比として定義されます。蒸気平衡と温度平衡が得られると、試料の水分活性は密閉された測定室内で試料を取り囲む空気の相対湿度と等しくなります。水分活性に100を乗じると、平衡相対湿度(ERH)(%)が得られます。
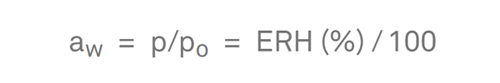
水分活性は、システム内の水のエネルギー状態を示す指標です。システム内の水分活性を制御する要因はいくつかあります。
- 溶解種(塩や砂糖など)が双極子-双極子結合、イオン結合、水素結合などを通じて水と相互作用する合体効果
- 毛細管効果:曲がった液体メニスカス上の水の蒸気圧が、水分子間の水素結合の変化により純水の蒸気圧より低くなる効果
- 水が、双極子-双極子力、イオン結合(H3O+またはOH-)、ファンデルワールス力(疎水性結合)、および水素結合を通じて、未溶解成分(デンプンやタンパク質など)の化学基と直接相互作用する表面間相互作用
食品に含まれるこれら3つの因子の組み合わせにより、水のエネルギーが減少し、純水と比較して相対湿度が低下します。これらの要因は、浸透圧効果とマトリックス効果という2つの大きなカテゴリーに分類することができます。
浸透圧およびマトリックス相互作用の程度が異なるため、水分活性はシステム内の水のエネルギー状態の連続性を表します。水は様々な程度の力によって「束縛」されているように見えます。これは、静的な「束縛」ではなく、エネルギー状態の連続体です。水の活性は、システム内の「自由水」、「結合水」、「利用可能水」と定義されることがあります。これらの用語は概念的にはわかりやすいのですが、水分活性の概念のすべての側面を適切に定義することはできません。
水分活性は温度に依存します。温度は、水の結合、水の解離、水への溶質の溶解度、またはマトリックスの状態の変化により、水分活性を変化させます。溶質の溶解度は制御因子となり得ますが、制御は通常マトリックスの状態から行われます。マトリックスの状態(ガラス状態かゴム状態か)は温度に依存するので、温度が食品の水分活性に影響を与えることは驚くにはあたりません。温度が食品の水分活性に及ぼす影響は、製品によって異なります。ある製品は温度の上昇とともに水分活性を増加し、ある製品は温度の上昇とともに水分活性を減少しますが、ほとんどの高水分食品は温度による変化が無視できるほど小さいものです。したがって、温度による水分活性の変化の方向さえも予測することはできません。なぜなら、その変化の方向は、食品中の水分活性を制御する要因に温度がどのように影響するかに左右されるからです。
潜在的なエネルギーとして測定される水分活性は、水分活性の高い領域から低い領域へ水を移動させる原動力となります。この水分活性の動的特性の例としては、マルチドメイン食品(例:クラッカー・チーズ・サンドイッチ)における水分移動、土壌から植物の葉への水分移動、細胞の膨圧などが挙げられます。微生物細胞は半透膜に囲まれた高濃度の溶質であるため、水の自由エネルギーに対する浸透圧効果は、微生物の水分関係、ひいてはその成長速度を決定する上で重要です。
品質保証(QA)/品質管理(QC)、及び配合のための強力な測定
水分活性は、製品に含まれる水のエネルギーを熱力学的に測定するものです。なぜ水分活性の測定方法を学ぶ必要があるのでしょうか。水分活性は、食品の微生物感受性に直接関係しているからです。また、食品の保存期間を終了させる多くの反応とも直接的な関係があります。水分活性は既知の標準を用いて測定されるため、安全性や品質の規格として特に適しています。


